Quest for the right Drug
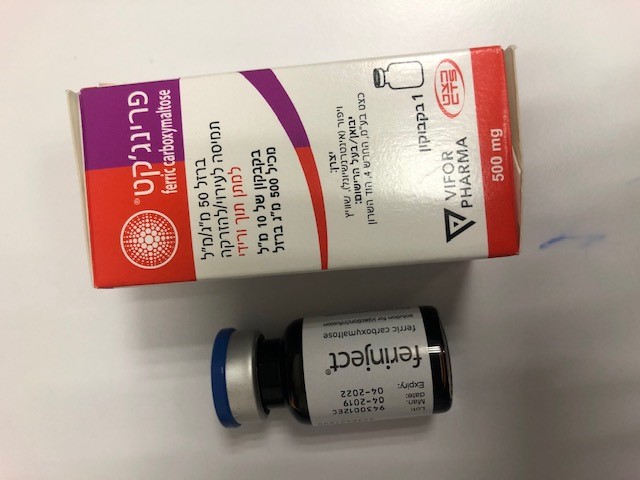
פרינג'קט FERINJECT (FERRIC CARBOXYMALTOSE)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תוך-ורידי : I.V
צורת מינון:
תמיסה להזרקהאינפוזיה : SOLUTION FOR INJECTION / INFUSION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Adverse reactions : תופעות לוואי
4.8 Undesirable effects Table 4 presents the adverse drug reactions (ADRs) reported during clinical studies in which >8,000 subjects received Ferinject, as well as those reported from the post-marketing experience (see table footnotes for details). The most commonly reported ADR is nausea (occurring in 2.9% of the subjects), followed by injection/infusion site reactions, hypophosphatemia, headache, flushing, dizziness and hypertension. Injection/infusion site reactions comprise several ADRs which individually are either uncommon or rare. The most serious ADR is anaphylactoid/anaphylactic reactions (rare);fatalities have been reported. See section 4.4 for further details. Table 4: Adverse drug reactions observed during clinical trials and post-marketing experience Common Uncommon (≥1/1,000 to Rare Frequency not System Organ Class (≥1/100 to <1/10) <1/100) (≥1/10,000 to <1/1,000) known(1) Immune system Hypersensitivity Anaphylactoid/anaphylactic disorders reactions Metabolism and Hypophosphataemia nutritional disorders Nervous system Headache, dizziness Paraesthesia, dysgeusia Loss of consciousness(1) disorders Psychiatric disorders Anxiety(2) Cardiac disorders Tachycardia Kounis syndrome(1) Vascular disorders Flushing, Hypotension Phlebitis, syncope(2), hypertension presyncope(2) Respiratory, thoracic Dyspnoea Bronchospasm(2) and mediastinal disorders Gastrointestinal Nausea Vomiting, dyspepsia, abdominal Flatulence disorders pain, constipation, diarrhoea Skin and subcutaneous Pruritus, urticaria, erythema, Angioedema(2), pallor(2), Face oedema(1) tissue disorders rash(3) Musculoskeletal and Myalgia, back pain, arthralgia, Hypophosphataemic connective tissue pain in extremity, muscle osteomalacia(1) disorders spasms General disorders and Injection/infusion site Pyrexia, fatigue, chest pain, Malaise, influenza like administration site reactions(4) oedema peripheral, chills illness (whose onset may conditions vary from a few hours to several days) (2) Investigations Alanine aminotransferase increased, aspartate aminostransferase increased, gamma-glutamyltransferase increased, blood lactate dehydrogenase increased, blood alkaline phosphatase increased 1. ADRs exclusively reported in the post-marketing setting; estimated as rare. 2. ADRs reported in the post-marketing setting which are also observed in the clinical setting. 3. Includes the following preferred terms: rash (individual ADR determined to be uncommon) and rash erythematous, - generalised, -macular, -maculo-papular, -pruritic (all individual ADRs determined to be rare). 4. Includes but is not limited to, the following preferred terms: injection/infusion site -pain, -haematoma, -discolouration, - extravasation, -irritation, -reaction, (all individual ADRs determined to be uncommon) and -paraesthesia (individual ADR determined to be rare). Note: ADR = Adverse drug reaction. Reporting of suspected adverse reactions: Reporting suspected adverse reactions after authorisation of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Any suspected adverse events should be reported to the Ministry of Health according to the National Regulation by using an online form https://sideeffects.health.gov.il/

פרטי מסגרת הכללה בסל
התרופה תינתן לטיפול בחסר בברזל בחולים בהם טיפול פומי בברזל איננו יעיל או שאינם יכולים לקבל טיפול פומי בברזל, העונים על אחד מאלה:1. חולי תסמונת HHT (Hereditary hemorrhagic telangiectasia) שמיצו את הטיפול הפומי בברזל, ואשר זקוקים לעירויי ברזל תוך ורידי תכופים או לצריכה מוגברת של מנות דם. התכשיר יינתן לחולים אשר כשלו בהגעה לרמת המוגלובין של 9 g/dL (או במקרים מיוחדים בהם לדעת הרופא המטפל רמת המוגלובין סבירה הינה שונה) ואשר זקוקים לאחד מאלה:א. עירויי ברזל תוך ורידי בתדירות של מעל לפעם בשבועייםב. צריכה מעל מנת דם אחת בחודש.2. ילדים הסובלים ממחלת מעיים דלקתית (Inflammatory bowel disease) שמיצו את הטיפול הפומי בברזל, ואשר זקוקים לעירויי ברזל תוך ורידי תכופים או לצריכה מוגברת של מנות דם.התכשיר יינתן לחולים העונים על אחד מאלה:א. במצב של התלקחות, שלא היה שיפור במחלתם לאחר חודשיים של טיפול ורמת ההמוגלובין שלהם מתחת ל- 10 g/dL; ב. במצב של התלקחות או הפוגה, אשר למעלה מ- 4 חודשים רמת ההמוגלובין שלהם אינה עולה על 11 g/dL;ג. קיבלו לפחות מנת דם אחת בזמן אשפוז, וזקוקים להמשך טיפול על מנת להגיע לרמת המוגלובין תקינה.
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
12/01/2014
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
עלון מידע לצרכן
14.12.14 - עלון לצרכן 22.02.17 - עלון לצרכן 05.09.18 - עלון לצרכן 26.02.19 - עלון לצרכן 07.03.22 - עלון לצרכן אנגלית 07.03.22 - עלון לצרכן עברית 07.03.22 - עלון לצרכן ערבית 27.03.24 - עלון לצרכן אנגלית 27.03.24 - עלון לצרכן עברית 27.03.24 - עלון לצרכן ערבית 20.01.20 - החמרה לעלון 30.03.21 - החמרה לעלון 07.04.21 - החמרה לעלון 07.03.22 - החמרה לעלון 27.03.24 - החמרה לעלוןלתרופה במאגר משרד הבריאות
פרינג'קט