Quest for the right Drug
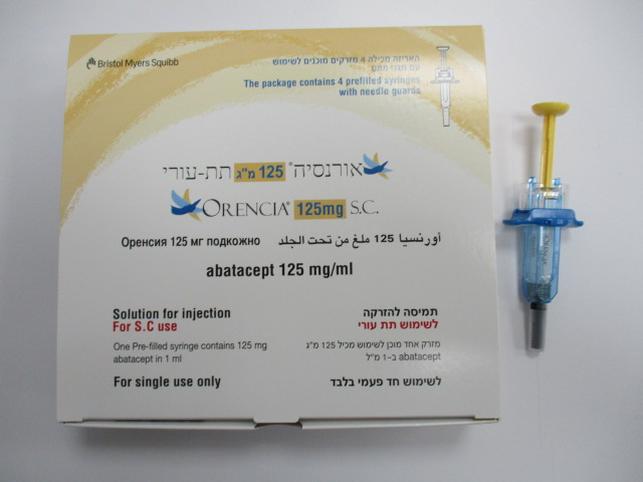
אורנסיה 125 מ"ג תת - עורי ORENCIA 125 MG SC (ABATACEPT)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תת-עורי : S.C
צורת מינון:
תמיסה להזרקה : SOLUTION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Posology : מינונים
2. DOSAGE AND ADMINISTRATION 2.1 Adult Rheumatoid Arthritis For adult patients with RA, ORENCIA may be administered as an intravenous infusion or as a subcutaneous injection. ORENCIA may be used as monotherapy or concomitantly with DMARDs other than TNF antagonists. Intravenous Dosing Regimen ORENCIA lyophilized powder should be reconstituted and administered after dilution [see Dosage and Administration (2.5)] as a 30-minute intravenous infusion utilizing the weight range-based dosing specified in Table 1. Following the initial intravenous administration, an intravenous infusion should be given at 2 and 4 weeks after the first infusion and every 4 weeks thereafter. Table 1: Dose of ORENCIA for Intravenous Infusion in Adult RA Patients Body Weight of Number of Patient Dose Vialsa Less than 60 kg 500 mg 2 60 to 100 kg 750 mg 3 More than 100 kg 1,000 mg 4 a Each vial provides 250 mg of abatacept for administration. Subcutaneous Dosing Regimen ORENCIA 125 mg in prefilled syringes should be administered by subcutaneous injection once weekly [see Dosage and Administration (2.6)] and may be initiated with or without an intravenous loading dose. For patients initiating therapy with an intravenous loading dose, ORENCIA should be initiated with a single intravenous infusion (as per body weight categories listed in Table 1), followed by the first 125 mg subcutaneous injection administered within a day of the intravenous infusion. Patients transitioning from ORENCIA intravenous therapy to subcutaneous administration should administer the first subcutaneous dose instead of the next scheduled intravenous dose. 2.2 Polyarticular Juvenile Idiopathic Arthritis For patients with juvenile idiopathic arthritis (JIA), ORENCIA may be administered as an intravenous infusion (6 years of age and older). Intravenous dosing has not been studied in patients younger than 6 years of age. Intravenous Dosing Regimen The recommended dose of ORENCIA for patients 6 to 17 years of age with juvenile idiopathic arthritis who weigh less than 75 kg is 10 mg/kg intravenously calculated based on the patient’s body weight at each administration. Pediatric patients weighing 75 kg or more should be administered ORENCIA following the adult intravenous dosing regimen, not to exceed a maximum dose of 1,000 mg. ORENCIA should be administered as a 30-minute intravenous infusion. Following the initial administration, ORENCIA should be given at 2 and 4 weeks after the first infusion and every 4 weeks thereafter. Any unused portions in the vials must be immediately discarded. Subcutaneous Dosing Regimen Subcutaneous ORENCIA is not indicated for use in Polyarticular Juvenile Idiopathic Arthritis. 2.3 Adult Psoriatic Arthritis For adult patients with psoriatic arthritis, ORENCIA may be administered as an intravenous infusion (IV) or a subcutaneous (SC) injection. ORENCIA can be used with or without non-biologic DMARDs. Intravenous Dosing Regimen ORENCIA IV should be administered as a 30-minute intravenous infusion utilizing the weight range-based dosing specified in Table 1. Following the initial intravenous administration, an intravenous infusion should be given at 2 and 4 weeks after the first infusion and every 4 weeks thereafter. Subcutaneous Dosing Regimen ORENCIA SC 125 mg should be administered by subcutaneous injection once weekly without the need for an intravenous loading dose. Patients switching from ORENCIA intravenous therapy to subcutaneous administration should administer the first subcutaneous dose instead of the next scheduled intravenous dose. 2.4 Dosage in Prophylaxis of Acute Graft versus Host Disease in Adults and Pediatric Patients Aged 6 Years and Older Antiviral Prophylactic Treatment Before administering ORENCIA, administer recommended antiviral prophylactic treatment for Epstein-Barr Virus (EBV) reactivation, and continue for six months following HSCT. In addition, consider prophylactic antivirals for Cytomegalovirus (CMV) infection/reactivation during treatment and for six months following HSCT [see Warnings and Precautions (5.7)]. Intravenous Dosing Regimen For patients 6 years and older, administer ORENCIA 10 mg/kg (maximum dose of 1,000 mg) as an intravenous infusion over 60 minutes on the day before transplantation (Day -1), followed by administration on Days 5, 14, and 28 after transplantation. 2.5 Preparation and Administration Instructions for Intravenous Infusion Use aseptic technique. ORENCIA for infusion is provided as a lyophilized powder in preservative-free, single-use vials. Each ORENCIA vial provides 250 mg of abatacept for administration. The ORENCIA powder in each vial must be reconstituted with 10 mL of Sterile Water for Injection, USP, using only the silicone-free disposable syringe provided with each vial and an 18- to 21-gauge needle. After reconstitution, the concentration of abatacept in the vial will be 25 mg/mL. If the ORENCIA powder is accidently reconstituted using a siliconized syringe, the solution may develop a few translucent particles. Discard any solutions prepared using siliconized syringes. If the silicone- free disposable syringe is dropped or becomes contaminated, use a new silicone- free disposable syringe from inventory. 1)Use 10 mL of Sterile Water for Injection, USP to reconstitute the ORENCIA powder. To reconstitute the ORENCIA powder, remove the flip-top from the vial and wipe the top with an alcohol swab. Insert the syringe needle into the vial through the center of the rubber stopper and direct the stream of Sterile Water for Injection, USP, to the glass wall of the vial. Do not use the vial if the vacuum is not present. Rotate the vial with gentle swirling to minimize foam formation, until the contents are completely dissolved. Do not shake. Avoid prolonged or vigorous agitation. 2) Upon complete dissolution of the lyophilized powder, the vial should be vented with a needle to dissipate any foam that may be present. After reconstitution, each milliliter will contain 25 mg (250 mg/10 mL). The solution should be clear to slightly opalescent and colorless to pale yellow. Do not use if opaque particles, discoloration, or other foreign particles are present. 3) The reconstituted ORENCIA solution must be further diluted to 100 mL as follows. From a 100 mL infusion bag or bottle, withdraw a volume of 0.9% Sodium Chloride Injection, USP, equal to the volume of the reconstituted ORENCIA solution required for the patient’s dose.Slowly add the reconstituted ORENCIA solution into the infusion bag or bottle using the same silicone-free disposable syringe provided with each vial. Gently mix. Do not shake the bag or bottle. The final concentration of abatacept in the bag or bottle will depend upon the amount of drug added, but will be no more than 10 mg/mL. Any unused portions in the ORENCIA vial must be immediately discarded. 4) Prior to administration, the ORENCIA solution should be inspected visually for particulate matter and discoloration. Discard the solution if any particulate matter or discoloration is observed. 5) Using an infusion set and a sterile, non-pyrogenic, low-protein-binding filter (pore size of 0.2 m to 1.2 m) , administer the entire diluted ORENCIA solution over: • 30 minutes for RA, pJIA, and PsA • 60 minutes for aGVHD prophylaxis 6) The infusion of the fully diluted ORENCIA solution must be completed within 24 hours of reconstitution of the ORENCIA vials. The fully diluted ORENCIA solution may be stored at room temperature or refrigerated at 2ºC to 8ºC (36ºF to 46ºF) and protected from light before use. Discard the fully diluted solution if not administered within 24 hours. 7) ORENCIA should not be infused concomitantly in the same intravenous line with other agents. No physical or biochemical compatibility studies have been conducted to evaluate the coadministration of ORENCIA with other agents. 2.6 General Considerations for Subcutaneous Administration ORENCIA prefilled syringes are intended for subcutaneous use only and are not intended for intravenous infusion. ORENCIA prefilled syringes are intended for use under the guidance of a physician or healthcare practitioner. After proper training in subcutaneous injection technique, a patient or caregiver may inject with ORENCIA if a physician/healthcare practitioner determines that it is appropriate. Patients and caregivers should be instructed to follow the directions provided in the Instructions for Use for additional details on medication administration. Inspect visually for particulate matter and discoloration prior to administration. Do not use ORENCIA prefilled syringes exhibiting particulate matter or discoloration. ORENCIA should be clear to slightly opalescent and colorless to pale yellow. Patients using ORENCIA prefilled syringes for subcutaneous administration should be instructed to inject the full amount (1 mL), which provides 125 mg of ORENCIA, according to the directions provided in the Instructions for Use. Injection sites should be rotated and injections should never be given into areas where the skin is tender, bruised, red, or hard.

פרטי מסגרת הכללה בסל
התרופה תינתן במקרים האלה: א. בשילוב עם התרופה Methotrexate לטיפול בדלקת פרקים מסוג Juvenile polyarticular idiopathic arthritis – בקטינים שמלאו להם 6 שנים ומעלה הסובלים ממהלך מחלה רב-מפרקי פעיל אם התגובה לטיפול בתרופות ממשפחת ה-DMARDs לא היתה מספקת, כולל טיפול במעכב TNF אחד, או שאינם מסוגלים לקבל טיפול כאמור; ב. ארתריטיס ראומטואידית כאשר התגובה לתכשירים ממשפחת ה-DMARDs איננה מספקת, בהתקיים כל אלה: 1. קיימת עדות לדלקת פרקים (RA-Rheumatoid Arthritis) פעילה המתבטאת בשלושה מתוך אלה: א. מחלה דלקתית (כולל כאב ונפיחות) בארבעה פרקים ויותר; ב. שקיעת דם או CRP החורגים מהנורמה באופן משמעותי (בהתאם לגיל החולה); ג. שינויים אופייניים ל-RA בצילומי רנטגן של הפרקים הנגועים; ד. פגיעה תפקודית המוגדרת כהגבלה משמעותית בתפקודו היומיומי של החולה ובפעילותו בעבודה. 2. לאחר מיצוי הטיפול בתרופות השייכות למשפחת ה-NSAIDs ובתרופות השייכות למשפחת ה-DMARDs. לעניין זה יוגדר מיצוי הטיפול כהעדר תגובה קלינית לאחר טיפול קו ראשון בתרופות אנטי דלקתיות ממשפחת ה-NSAIDs וטיפול קו שני ב-3 תרופות לפחות ממשפחת ה-DMARDs שאחת מהן מתוטרקסאט, במשך 3 חודשים רצופים לפחות. 3. הטיפול יינתן באישור רופא מומחה בראומטולוגיה.ג. דלקת מפרקים פסוריאטית פעילה ומתקדמת כאשר התגובה לתכשירים ממשפחת ה-DMARDs איננה מספקת.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| דלקת מפרקים פסוריאטית פעילה ומתקדמת כאשר התגובה לתכשירים ממשפחת ה-DMARDs איננה מספקת | ||||
| ארתריטיס ראומטואידית כאשר התגובה לתכשירים ממשפחת ה-DMARDs איננה מספקת | ||||
| לטיפול בדלקת פרקים מסוג Juvenile polyarticular idiopathic arthritis |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
10/01/2012
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
רישום
149 54 33788 00
מחיר
0 ₪
מידע נוסף
