Quest for the right Drug
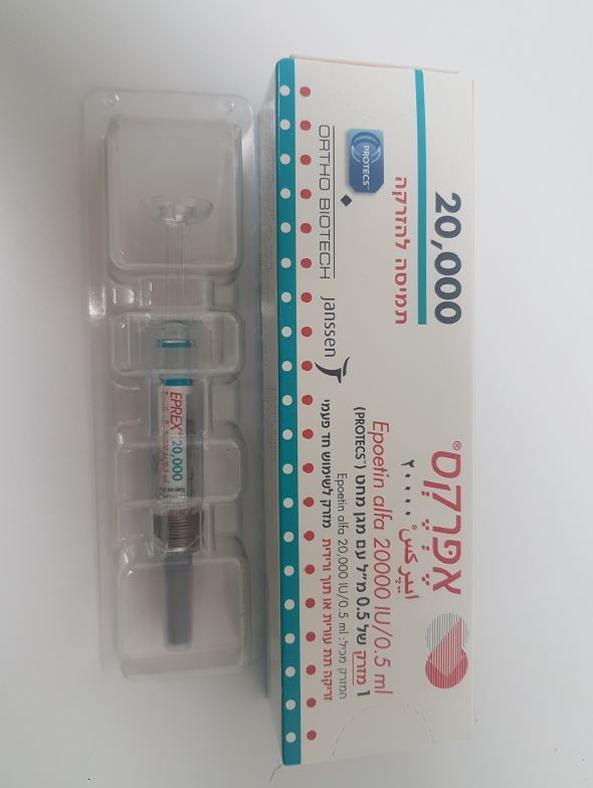
אפרקס 20000 EPREX 20000 (ERYTHROPOIETIN HUMAN RECOMBINANT)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תוך-ורידי, תת-עורי : I.V, S.C
צורת מינון:
תמיסה להזרקה : SOLUTION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Adverse reactions : תופעות לוואי
4.8 Undesirable effects Summary of Safety Profile The most frequent adverse drug reaction during treatment with epoetin alfa is a dose-dependent increase in blood pressure or aggravation of existing hypertension. Monitoring of the blood pressure should be performed, particularly at the start of therapy (see section 4.4). The most frequently occurring adverse drug reactions observed in clinical trials of epoetin alfa are diarrhoea, nausea, vomiting, pyrexia and headache. Influenza-like illness may occur especially at the start of treatment. Respiratory tract congestion, which includes events of upper respiratory tract congestion, nasal congestion and nasopharyngitis, have been reported in studies with extended interval dosing in adult patients with renal insufficiency not yet undergoing dialysis. An increased incidence of thrombotic vascular events (TVEs) has been observed in patients receiving ESAs (see section 4.4). Tabulated List of Adverse Reactions Of a total 3,417 subjects in 25 randomized, double-blinded, placebo or standard of care controlled studies, the overall safety profile of EPREX was evaluated in 2,094 anaemic subjects. Included were 228 epoetin alfa-treated CRF subjects in 4 chronic renal failure studies (2 studies in predialysis [N = 131 exposed CRF subjects] and 2 in dialysis [N = 97 exposed CRF subjects]; 1,404 exposed cancer subjects in 16 studies of anaemia due to chemotherapy; 147 exposed subjects in 2 studies for autologous blood donation; 213 exposed subjects in 1 study in the perisurgical period Adverse drug reactions reported by ≥1% of subjects treated with epoetin alfa in these trials are shown in the table below. Frequency estimate: Very common (≥ 1/10), Common (≥ 1/100 to < 1/10), Uncommon (≥ 1/1,000 to < 1/100), Rare (≥ 1/10,000 to < 1/1,000), Very Rare (< 1/10,000), Not known (cannot be estimated from the available data). MedDRA System Organ Classification Adverse Reaction (Preferred Frequency (SOC) Term Level) Blood and lymphatic system disorders Pure red cell aplasia3, Rare Thrombocythemia Metabolism and nutrition disorders Hyperkalaemia1 Uncommon Immune system disorders Hypersensitivity3 Uncommon Anaphylactic reaction3 Rare Nervous system disorders Headache Common Convulsion Uncommon Vascular disorders Hypertension, Venous and arterial Common thromboses2 Hypertensive crisis3 Not known Respiratory, thoracic and mediastinal disorders Cough Common Respiratory tract congestion Uncommon Gastrointestinal disorders Diarrhoea, Nausea, Vomiting Very common Skin and subcutaneous tissue disorders Rash Common Urticaria3 Uncommon Angioneurotic oedema3 Not known Musculoskeletal and connective tissue disorders Arthralgia, Bone pain, Myalgia, Common Pain in extremity Page 15 of 25 Congenital, familial and genetic disorders Porphyria acute3 Rare General disorders and administration Pyrexia Very common site conditions Chills, Influenza like illness, Common Injection site reaction, Oedema peripheral Drug ineffective3 Not known Investigations Anti-erythropoeitin antibody Rare positive 1 Common in dialysis 2 Includes arterial and venous, fatal and non fatal events, such as deep venous thrombosis, pulmonary emboli, retinal thrombosis, arterial thrombosis (including myocardial infarction), cerebrovascular accidents (including cerebral infarction and cerebral haemorrhage) transient ischaemic attacks, and shunt thrombosis (including dialysis equipment) and thrombosis within arteriovenous shunt aneurisms 3 Addressed in the subsection below and/or in section 4.4 Description of selected adverse reactions Hypersensitivity reactions, including cases of rash (including urticaria), anaphylactic reactions, and angioneurotic oedema have been reported. Severe cutaneous adverse reactions (SCARs) including Stevens-Johnson syndrome (SJS) and toxic epidermal necrolysis (TEN), which can be life-threatening or fatal, have been reported in association with epoetin treatment (see section 4.4). Hypertensive crisis with encephalopathy and seizures, requiring the immediate attention of a physician and intensive medical care, have occurred also during epoetin alfa treatment in patients with previously normal or low blood pressure. Particular attention should be paid to sudden stabbing migraine-like headaches as a possible warning signal (see section 4.4). Antibody-mediated pure red cell aplasia has been very rarely reported in < 1/10,000 cases per patient year after months to years of treatment with EPREX (see section 4.4). More cases have been reported with subcutaneous (SC) route of administration, compared with the IV route. Paediatric population with chronic renal failure on haemodialysis The exposure of paediatric patients with chronic renal failure on haemodialysis in clinical trials and post-marketing experience is limited. No paediatric-specific adverse reactions not mentioned previously in the table above, or any that were not consistent with the underlying disease were reported in this population. Reporting of suspected adverse reactions Reporting suspected adverse reactions after authorization of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Any suspected adverse events should be reported to the Ministry of Health according to the National Regulation by using an online form http://sideeffects.health.gov.il

פרטי מסגרת הכללה בסל
התרופה תינתן בכל אחד מאלה: 1. אנמיה חמורה (severe anemia) בחולי אי ספיקה כלייתית כרונית. 2. חולים אנמיים הסובלים ממחלה ממאירה והמקבלים טיפול פעיל ייעודי במחלתם וכן לחולים הסובלים ממיאלומה נפוצה (multiple myeloma) או מהתסמונת המיאלודיספלסטית (myelodisplastic syndrome) שנתקיימו בהם כל אלה: 1. אחד מהתנאים האלה: א. רמת המוגלובין נמוכה מ-8 גרם %. ב. החולה מרותק למיטתו בגלל אנמיה המלווה במחלת לב איסכמית או באי ספיקה לבבית. ג. החולה נזקק לקבלת שתי מנות דם לפחות פעם בשבועיים במשך חודשיים. 2. נשללה סיבה אחרת לאנמיה שאינה קשורה לטיפול הייעודי במחלתם האמורה לעיל ובכלל זה דימום, חוסר ברזל, חוסר חומצה פולית, חוסר ויטמין B12 והמוליזה. 3. רמת אריתרופואטין בנסיוב נמוכה מ-100 mu/ml.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| חולים אנמיים הסובלים ממחלה ממאירה והמקבלים טיפול פעיל ייעודי במחלתם וכן לחולים הסובלים ממיאלומה נפוצה (multiple myeloma) או מהתסמונת המיאלודיספלסטית (myelodisplastic syndrome | 01/02/2001 | המטולוגיה | ||
| אנמיה חמורה (severe anemia) בחולי אי ספיקה כלייתית כרונית. | 01/02/2001 | המטולוגיה | ||
| oncology | 01/02/2001 | DARBEPOETIN ALFA, EPOETIN ALFA, EPOETIN BETA, EPOETIN THETA (R-HUEPO) | ||
| CKD | 01/02/2001 | DARBEPOETIN ALFA, EPOETIN BETA, EPOETIN ALFA, METHOXY POLYETHYLENE GLYCOL-EPOETIN BETA, EPOETIN THETA (R-HUEPO) |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
01/01/1995
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
