Quest for the right Drug
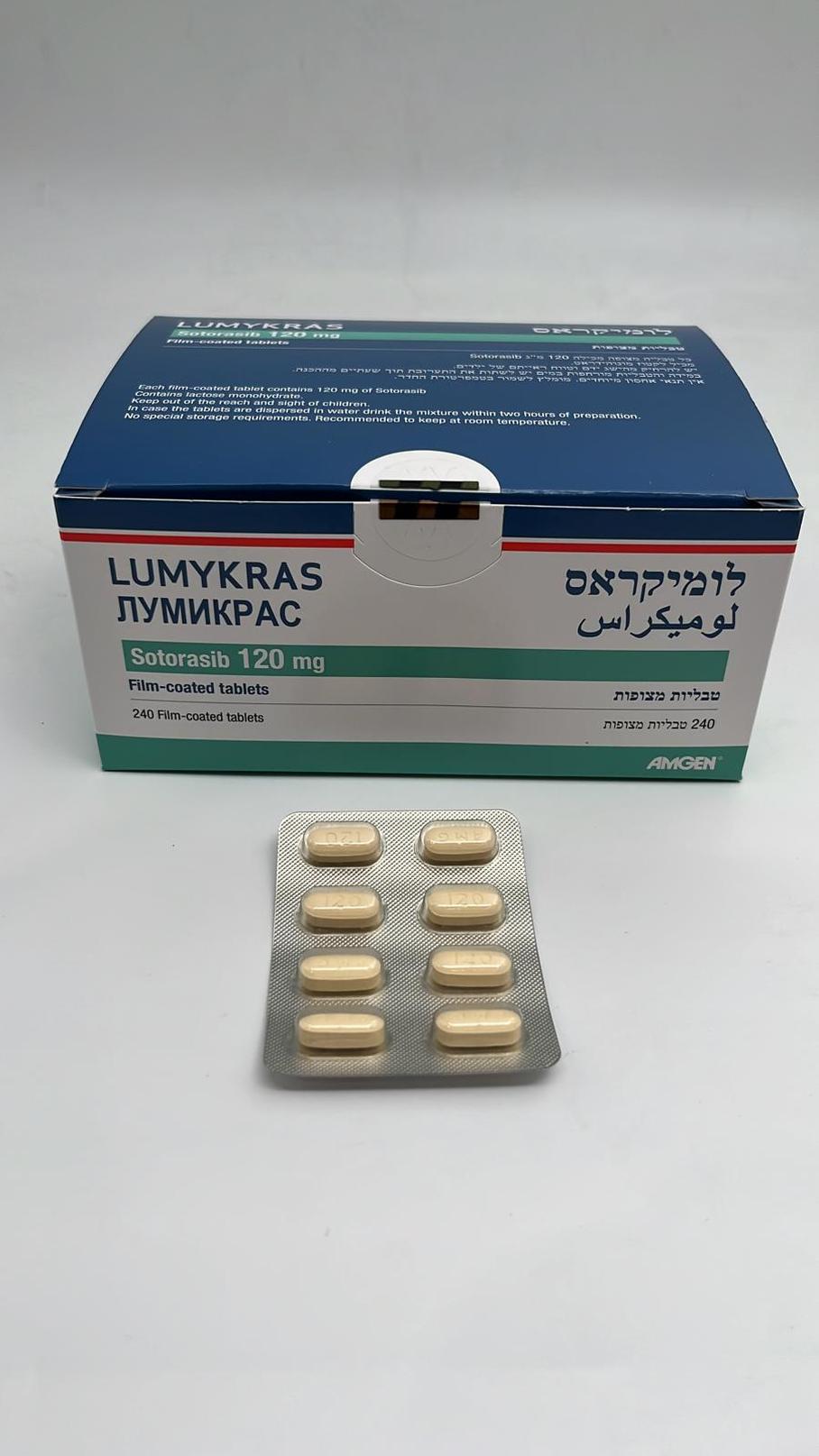
לומיקראס LUMYKRAS (SOTORASIB)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
פומי : PER OS
צורת מינון:
טבליות מצופות פילם : FILM COATED TABLETS
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Pharmaceutical particulars : מידע רוקחי
6. PHARMACEUTICAL PARTICULARS 6.1 List of excipients Tablet core Cellulose, microcrystalline (E460(i)) Lactose monohydrate Croscarmellose sodium (E468) Magnesium stearate, Non-bovine (E470b) Film-coating Polyvinyl alcohol (E1203) Titanium dioxide (E171) Macrogol 4000 (E1521) Talc (E553b) Iron oxide yellow (E172) 6.2 Incompatibilities In the absence of compatibility studies, this medicinal product must not be dispersed with other liquids than that mentioned in section 4.2. Acidic beverages (e.g. fruit juices) should also be excluded. 6.3 Shelf life The expiry date of the product is indicated on the packaging materials 6.4 Special precautions for storage This medicinal product does not require any special storage conditions. 6.5 Nature and contents of container PVC/PE/PVDC blisters with aluminium foil backing containing 8 film-coated tablets. Pack sizes of 240 film-coated tablets (1 carton with 30 blisters). HDPE bottle with a child-resistant polypropylene cap and aluminium foil induction seal liner containing 120 film-coated tablets. Pack size of 240 film-coated tablets (1 carton with 2 bottles). Not all pack sizes may be marketed. 6.6 Special precautions for disposal This medicinal product may pose a risk to the environment (see section 5.3). Any unused medicinal product or waste material should be disposed of in accordance with local requirements.

שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
לא צוין
הגבלות
לא צוין
מידע נוסף
