Quest for the right Drug
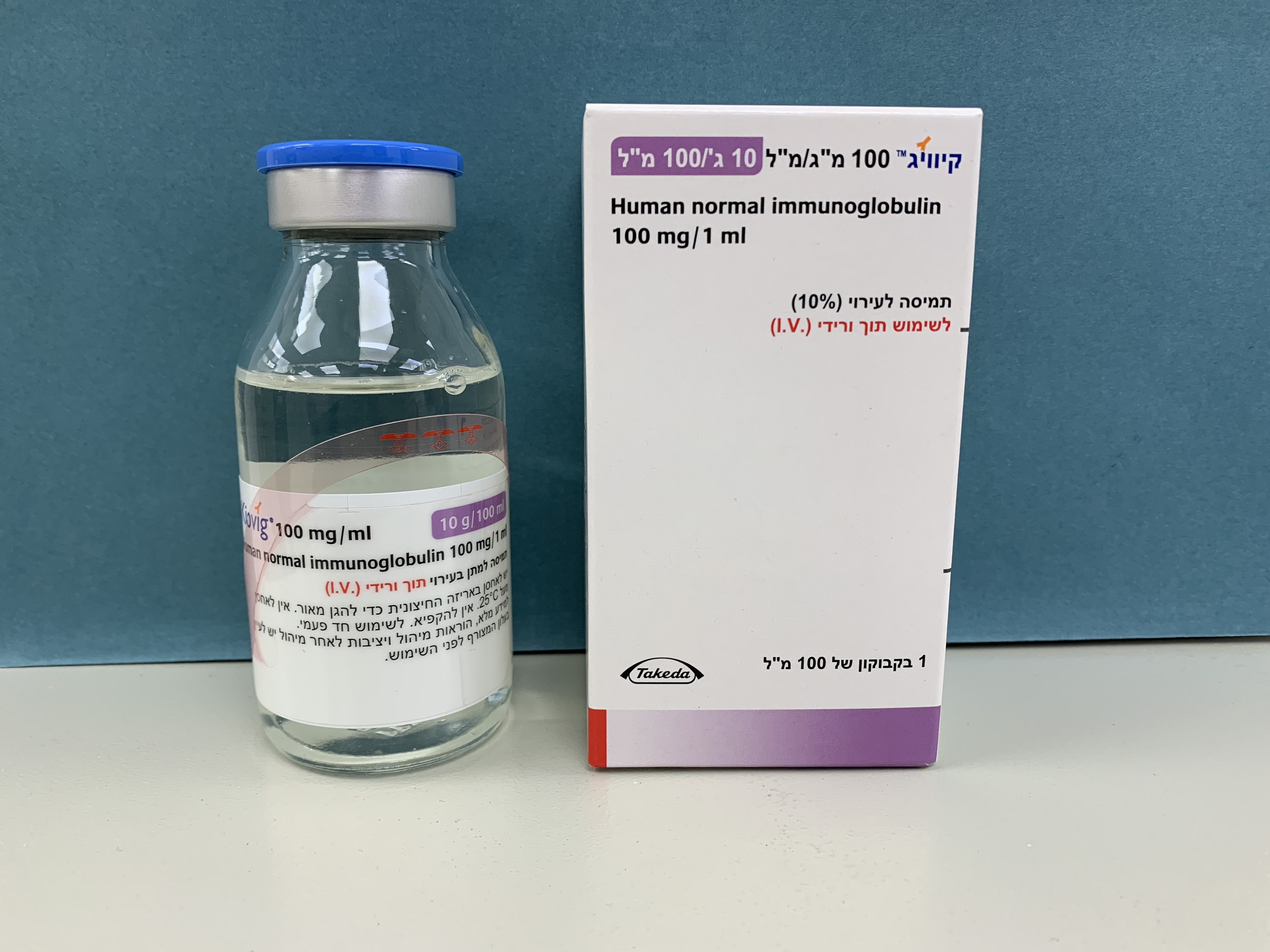
קיוויג 100 מ"ג/מ"ל KIOVIG 100 MG/ML (IMMUNOGLOBULINS, NORMAL HUMAN)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תוך-ורידי : I.V
צורת מינון:
תמיסה לאינפוזיה : SOLUTION FOR INFUSION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Pharmacological properties : תכונות פרמקולוגיות
Pharmacodynamic Properties
5.1 Pharmacodynamic properties Pharmacotherapeutic group: immune sera and immunoglobulins: immunoglobulins, normal human, for intravascular administration, ATC code: J06BA02 Human normal immunoglobulin contains mainly immunoglobulin G (IgG) with a broad spectrum of antibodies against infectious agents. Human normal immunoglobulin contains the IgG antibodies present in the normal population. It is usually prepared from pooled plasma from not fewer than 1000 donations. It has a distribution of immunoglobulin G subclasses closely proportional to that in native human plasma. Adequate doses of of this medicinal product may restore abnormally low immunoglobulin G levels to the normal range. The mechanism of action in indications other than replacement therapy is not fully elucidated, but includes immunomodulatory effects. Paediatric population There are no theoretical or observed differences in the action of immunoglobulins in children compared to adults.
Pharmacokinetic Properties
5.2 Pharmacokinetic properties Human normal immunoglobulin is immediately and completely bioavailable in the recipient’s circulation after intravenous administration. It is distributed relatively rapidly between plasma and extravascular fluid; after approximately 3 to 5 days equilibrium is reached between the intra- and extravascular compartments. Pharmacokinetic parameters for KIOVIG were determined in the two clinical studies in PID patients performed in Europe and the US. In these studies, a total of 83 subjects at least 2 years of age were treated with doses of 300 to 600 mg/kg body weight every 21 to 28 days for 6 to 12 months. The median IgG half-life after administration of KIOVIG was 32.5 days. This half- life may vary from patient to patient, in particular in primary immunodeficiency. Pharmacokinetic parameters for the product are summarized in the table below. All parameters were analysed separately for three age groups, children (below 12 years, n=5), adolescents (13 to 17 years, n=10), and adults (above 18 years of age, n=64). The values obtained in the studies are comparable to parameters reported for other human immunoglobulins. Summary of KIOVIG pharmacokinetic parameters Children Adolescents Adults Parameter (12 years or below) (13 to 17 years) (18 years or above) Median 95% CI* Median 95% CI Median 95% CI Terminal half-life (days) 41.3 20.2 to 86.8 45.1 27.3 to 89.3 31.9 29.6 to 36.1 Cmin (mg/dl)/(mg/kg) 2.28 1.72 to 2.74 2.25 1.98 to 2.64 2.24 1.92 to 2.43 (trough level) Cmax (mg/dl)/(mg/kg) 4.44 3.30 to 4.90 4.43 3.78 to 5.16 4.50 3.99 to 4.78 (peak level) In-vivo recovery (%) 121 87 to 137 99 75 to 121 104 96 to 114 Incremental recovery 2.26 1.70 to 2.60 2.09 1.78 to 2.65 2.17 1.99 to 2.44 (mg/dl)/(mg/kg) AUC0-21d (g·h/dl) (area 1.49 1.34 to 1.81 1.67 1.45 to 2.19 1.62 1.50 to 1.78 under the curve) *CI – Confidence Interval IgG and IgG-complexes are broken down in cells of the reticuloendothelial system.

פרטי מסגרת הכללה בסל
התרופה תינתן לטיפול במקרים האלה: א. חסר חיסוני ראשוני (חולים עם פגיעה ראשונית בייצור נוגדנים כגון אגמגלובולינמיה או היפוגמגלובוילינמיה, ITP (Idiopathic thrombocytopenic purpura)); ב. חסר חיסוני ספציפי, מניעה או טיפול בחצבת, הפטיטיס A ויראלית; ג. CIDP – Chronic inflammatory demyelineating polyneuropathy; ד.טיפול בחולי לוקמיה מסוג CLL הסובלים מהיפוגלמגלובולינמיה משנית חמורה וזיהומים חוזרים.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| טיפול בחולי לוקמיה מסוג CLL הסובלים מהיפוגלמגלובולינמיה משנית חמורה וזיהומים חוזרים. | 01/01/1995 | |||
| CIDP – Chronic inflammatory demyelineating polyneuropathy; | 01/01/1995 | |||
| חסר חיסוני ספציפי, מניעה או טיפול בחצבת, הפטיטיס A ויראלית | 01/01/1995 | |||
| חסר חיסוני ראשוני (חולים עם פגיעה ראשונית בייצור נוגדנים כגון אגמגלובולינמיה או היפוגמגלובולינמיה, ITP (Idiopathic thrombocytopenic purpura)); | 01/01/1995 |
שימוש לפי פנקס קופ''ח כללית 1994
Primary immunodeficiency (patients with primary defective antibody synthesis such as agammaglobulinemia or hypogammaglobulinemia, idiopathic thrombocytopenic purpura (ITP)
תאריך הכללה מקורי בסל
01/01/1995
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
