Quest for the right Drug
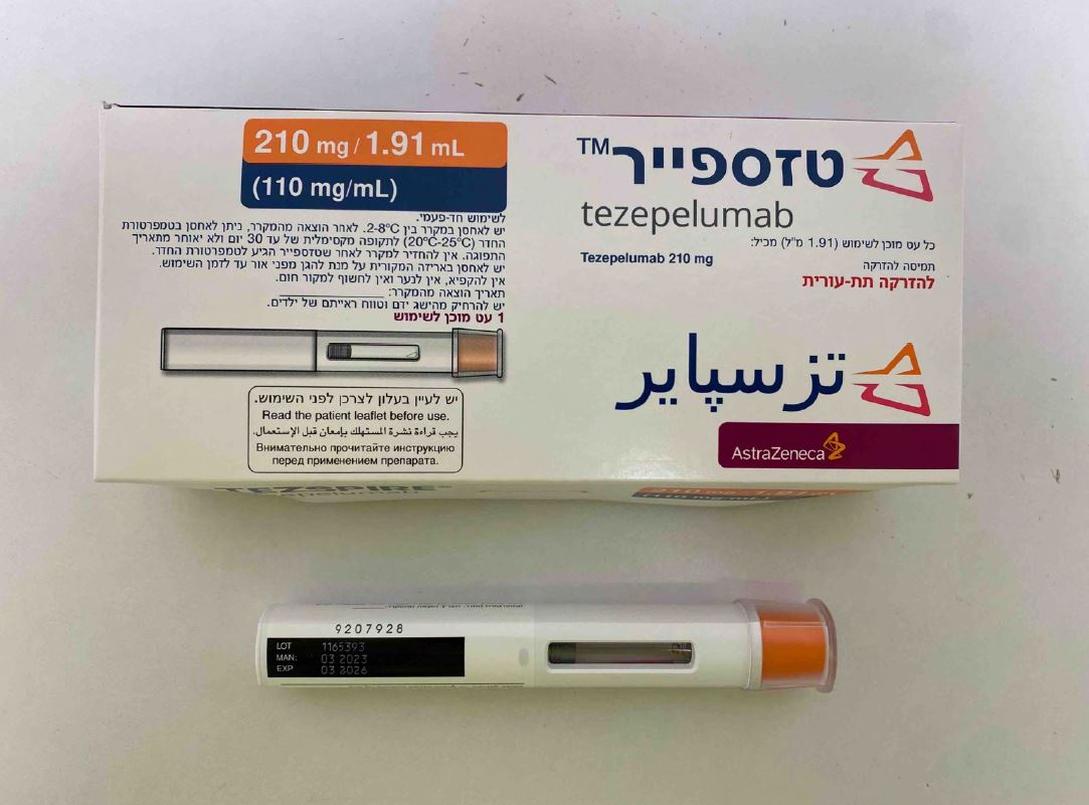
טזספייר TEZSPIRE (TEZEPELUMAB)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תת-עורי : S.C
צורת מינון:
תמיסה להזרקה : SOLUTION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Special Warning : אזהרת שימוש
4.4 Special warnings and precautions for use Acute asthma exacerbations Tezspire should not be used to treat acute asthma exacerbations. Asthma-related symptoms or exacerbations may occur during treatment. Patients should be instructed to seek medical advice if their asthma remains uncontrolled or worsens after initiation of treatment. Corticosteroids Abrupt discontinuation of corticosteroids after initiation of therapy is not recommended. Reduction in corticosteroid doses, if appropriate, should be gradual and performed under the supervision of a physician. Hypersensitivity reactions Hypersensitivity reactions (e.g. anaphylaxis, rash) may occur following administration of tezepelumab (see section 4.8). These reactions may occur within hours of administration, but in some instances have a delayed onset (i.e. days). A history of anaphylaxis unrelated to tezepelumab may be a risk factor for anaphylaxis following Tezspire administration. In line with clinical practice, patients should be monitored for an appropriate time after administration of Tezspire. In the event of a serious hypersensitivity reaction (e.g. anaphylaxis), administration of tezepelumab should be discontinued immediately and appropriate treatment as clinically indicated should be initiated. Serious infections Blocking thymic stromal lymphopoietin (TSLP) may theoretically increase the risk of serious infections. In placebo-controlled studies, no increase in serious infections was observed with tezepelumab. Patients with pre-existing serious infections should be treated before initiating therapy with tezepelumab. If patients develop a serious infection while receiving tezepelumab treatment, therapy with tezepelumab should be discontinued until the serious infection resolves. Serious cardiac events In a long-term clinical study, a numerical imbalance in serious cardiac adverse events was observed in patients treated with tezepelumab compared to placebo. No causal relationship between tezepelumab and these events has been established, nor has a patient population at risk of these events been identified. Patients should be advised of signs or symptoms suggestive of a cardiac event (for example, chest pain, dyspnoea, malaise, feeling lightheaded or faint) and to seek immediate medical attention if such symptoms occur. If patients develop a serious cardiac event while receiving tezepelumab treatment, therapy with tezepelumab should be discontinued until the acute event stabilises. There is currently no data on re-treatment of patients who develop a serious cardiac event or serious infection. Parasitic (helminth) infection TSLP may be involved in the immunological response to some helminth infections. Patients with known helminth infections were excluded from participation in clinical trials. It is unknown if tezepelumab may influence a patient’s response against helminth infections. Patients with pre-existing helminth infections should be treated before initiating therapy with tezepelumab. If patients become infected while receiving treatment and do not respond to anti- helminth treatment, therapy with tezepelumab should be discontinued until infection resolves. Sodium content This medicinal product contains less than 1 mmol sodium (23 mg) per 210 mg dose, that is to say essentially ‘sodium-free’.
Effects on Driving
4.7 Effects on ability to drive and use machines Tezspire has no or negligible influence on the ability to drive and use machines.

פרטי מסגרת הכללה בסל
א. התרופה תינתן לטיפול באסתמה אאוזינופילית חמורה בחולים בני 12 שנים ומעלה העונים על כל אלה: 1. אסתמה בדרגת חומרה קשה (על פי הנחיות GINA) שאובחנה ע"י מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית, המוגדרת לפי שימוש קבוע ב-ICS במינון גבוה (על פי הנחיות GINA) יחד עם תרופה שנייה, בדרך כלל LABA. 2. עונים על אחד מאלה:א. אאוזינופיליה בדם ברמה של 400 תאים פר מיקרוליטר ומעלה, בשתי בדיקות דם מהשנתיים האחרונות, אשר עונים על לפחות אחד מאלה:1. שתי החמרות או יותר אשר לפחות אחת מהן הצריכה פניה למיון או אשפוז בשנה האחרונה עקב אסתמה לא מאוזנת.2. שלוש החמרות או יותר בשנה האחרונה שנזקקו לטיפול בסטרואידים סיסטמיים במשך לפחות שלושה ימים. 3. חולי אסתמה הזקוקים לטיפול קבוע בקורטיקוסטרואידים במתן פומי למשך לפחות 50% מהזמן במטרה לשלוט במחלה. ב. אאוזינופיליה של 300 תאים למיקרוליטר ומטה בשנתיים האחרונות העונים על אחד מאלה:1. שתי החמרות או יותר אשר לפחות אחת מהן הצריכה פניה למיון או אשפוז בשנה האחרונה עקב אסתמה לא מאוזנת.2. שלוש החמרות או יותר בשנה האחרונה שנזקקו לטיפול בסטרואידים סיסטמיים במשך לפחות שלושה ימים. ב. הטיפול לא יינתן בשילוב עם Dupilumab או בשילוב עם Omalizumab או בשילוב עם תרופות ממשפחת מעכבי IL5. ג. הטיפול בתרופה האמורה ייעשה לפי מרשם של רופא מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| א. התרופה תינתן לטיפול באסתמה אאוזינופילית חמורה בחולים בני 12 שנים ומעלה העונים על כל אלה: 1. אסתמה בדרגת חומרה קשה (על פי הנחיות GINA) שאובחנה ע"י מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית, המוגדרת לפי שימוש קבוע ב-ICS במינון גבוה (על פי הנחיות GINA) יחד עם תרופה שנייה, בדרך כלל LABA. 2. עונים על אחד מאלה: א. אאוזינופיליה בדם ברמה של 400 תאים פר מיקרוליטר ומעלה, בשתי בדיקות דם מהשנתיים האחרונות, אשר עונים על לפחות אחד מאלה: 1. שתי החמרות או יותר אשר לפחות אחת מהן הצריכה פניה למיון או אשפוז בשנה האחרונה עקב אסתמה לא מאוזנת. 2. שלוש החמרות או יותר בשנה האחרונה שנזקקו לטיפול בסטרואידים סיסטמיים במשך לפחות שלושה ימים. 3. חולי אסתמה הזקוקים לטיפול קבוע בקורטיקוסטרואידים במתן פומי למשך לפחות 50% מהזמן במטרה לשלוט במחלה. ב. אאוזינופיליה של 300 תאים למיקרוליטר ומטה בשנתיים האחרונות העונים על אחד מאלה: 1. שתי החמרות או יותר אשר לפחות אחת מהן הצריכה פניה למיון או אשפוז בשנה האחרונה עקב אסתמה לא מאוזנת. 2. שלוש החמרות או יותר בשנה האחרונה שנזקקו לטיפול בסטרואידים סיסטמיים במשך לפחות שלושה ימים. ב. הטיפול לא יינתן בשילוב עם Dupilumab או בשילוב עם Omalizumab או בשילוב עם תרופות ממשפחת מעכבי IL5. ג. הטיפול בתרופה האמורה ייעשה לפי מרשם של רופא מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית. | 01/02/2023 | רפואת ריאות | אסטמה אאוזינופילית, Eosinophilic asthma |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
01/02/2023
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
עלון מידע לצרכן
10.05.23 - עלון לצרכן אנגלית 08.06.23 - עלון לצרכן עברית 10.05.23 - עלון לצרכן ערבית 22.08.23 - עלון לצרכן אנגלית 22.08.23 - עלון לצרכן עברית 22.08.23 - עלון לצרכן ערבית 15.03.24 - עלון לצרכן עברית 15.03.24 - עלון לצרכן עברית 28.06.24 - עלון לצרכן אנגלית 28.06.24 - עלון לצרכן ערבית 12.07.24 - עלון לצרכן אנגלית 12.07.24 - עלון לצרכן ערבית 10.05.23 - החמרה לעלון 08.06.23 - החמרה לעלון 15.03.24 - החמרה לעלוןלתרופה במאגר משרד הבריאות
טזספייר