Quest for the right Drug
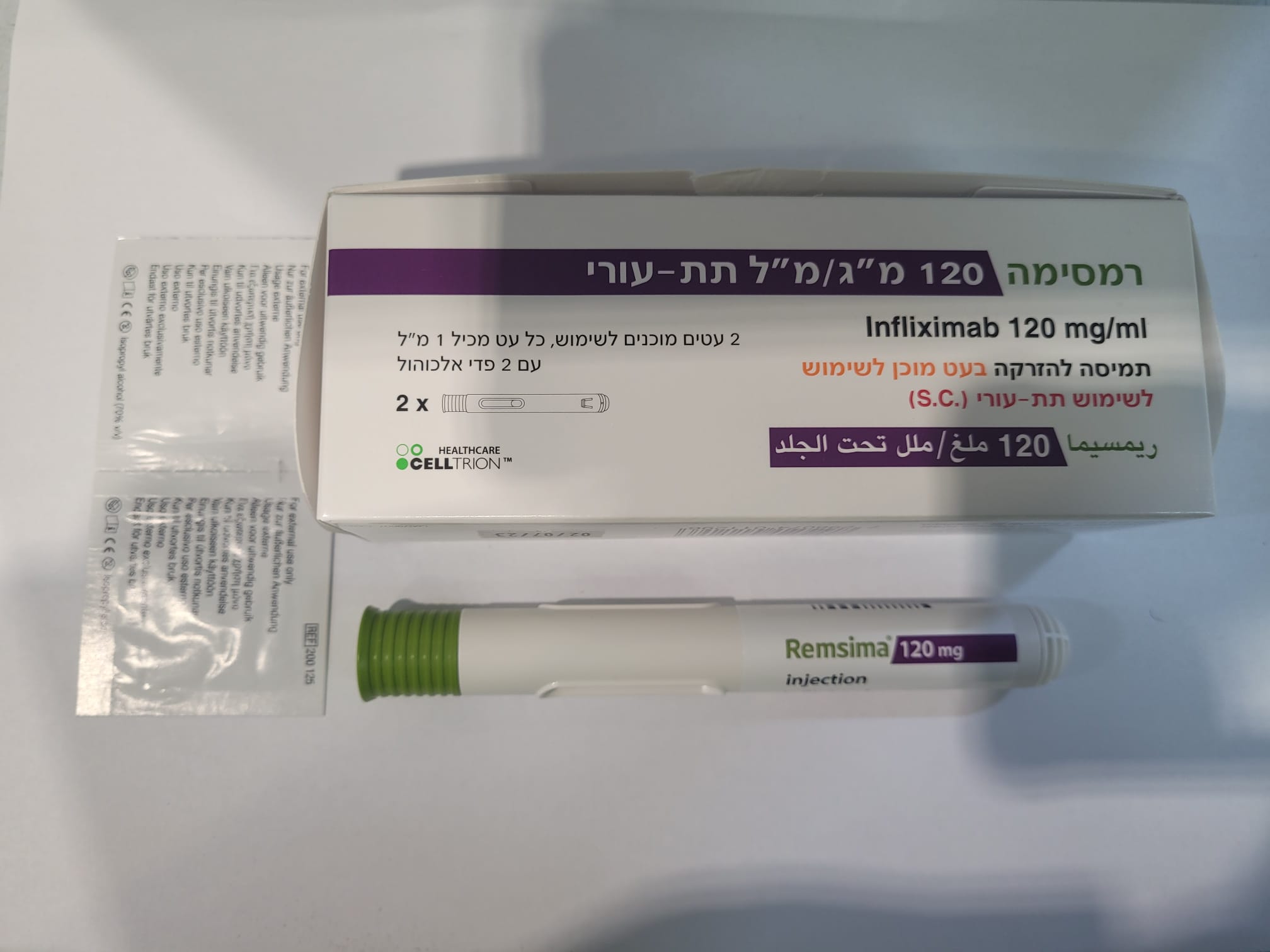
רמסימה 120 מ"ג/מ"ל תת-עורי REMSIMA 120 MG/ML S.C. (INFLIXIMAB)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תת-עורי : S.C
צורת מינון:
תמיסה להזרקה : SOLUTION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Posology : מינונים
4.2 Posology and method of administration Remsima treatment is to be initiated and supervised by qualified physicians experienced in the diagnosis and treatment of conditions for which Remsima is indicated. Patients treated with Remsima should be given the package leaflet and the patient safety information card. Instruction for use is provided in the package leaflet. For subsequent injections and after proper training in subcutaneous injection technique, patients may self-inject with Remsima if their physician determines that it is appropriate and with medical follow- up as necessary. Suitability of the patient for subcutaneous home use should be assessed and patients should be advised to inform their healthcare professional if they experience symptoms of an allergic reaction before administering the next dose. Patients should seek immediate medical attention if developing symptoms of serious allergic reactions (see section 4.4). During Remsima treatment, other concomitant therapies, e.g., corticosteroids and immunosuppressants should be optimised. It is important to check the product labels to ensure that the correct formulation (intravenous or subcutaneous) is being administered to the patient, as prescribed. Remsima subcutaneous formulation is not intended for intravenous administration and should be administered via a subcutaneous injection only. Posology Adults (≥18 years) Rheumatoid arthritis Treatment with Remsima administered subcutaneously should be initiated as maintenance therapy 4 weeks after the last administration of two intravenous infusions of infliximab 3 mg/kg given 2 weeks apart. The recommended dose for Remsima subcutaneous formulation is 120 mg once every 2 weeks. Remsima must be given concomitantly with methotrexate. Available data suggest that the clinical response is usually achieved within 12 weeks of treatment. Continued therapy should be carefully reconsidered in patients who show no evidence of therapeutic benefit within the first 12 weeks of treatment (see section 5.1). Moderately to severely active Crohn’s disease Treatment with Remsima administered subcutaneously should be initiated as maintenance therapy 4 weeks after the last administration of two intravenous infusions of infliximab 5 mg/kg given 2 weeks apart. The recommended dose for Remsima subcutaneous formulation is 120 mg once every 2 weeks. If a patient does not respond after 2 doses of intravenous infusions, no additional treatment with infliximab should be given. Available data do not support further infliximab treatment, in patients not responding within 6 weeks of the initial infusion. Fistulising, active Crohn’s disease Remsima 120 mg given as a subcutaneous injection 4 weeks after the last administration of two intravenous infusions of infliximab 5 mg/kg given 2 weeks apart. The recommended dose for Remsima subcutaneous formulation is 120 mg once every 2 weeks. If a patient does not respond after 6 doses (i.e. 2 intravenous infusions and 4 subcutaneous injections), no additional treatment with infliximab should be given. In Crohn’s disease, experience with re-administration if signs and symptoms of disease recur is limited and comparative data on the benefit/risk of the alternative strategies for continued treatment are lacking. Ulcerative colitis Treatment with Remsima administered subcutaneously should be initiated as maintenance therapy 4 weeks after the last administration of two intravenous infusions of infliximab 5 mg/kg given 2 weeks apart. The recommended dose for Remsima subcutaneous formulation is 120 mg once every 2 weeks. Available data suggest that the clinical response is usually achieved within 14 weeks of treatment, i.e. 2 intravenous infusions and 4 subcutaneous injections (see section 5.1). Continued therapy should be carefully reconsidered in patients who show no evidence of therapeutic benefit within this time period. Ankylosing spondylitis Treatment with Remsima administered subcutaneously should be initiated as maintenance therapy 4 weeks after the last administration of two intravenous infusions of infliximab 5 mg/kg given 2 weeks apart. The recommended dose for Remsima subcutaneous formulation is 120 mg once every 2 weeks. If a patient does not respond by 6 weeks (i.e. after 2 intravenous infusions), no additional treatment with infliximab should be given. Psoriatic arthritis Treatment with Remsima administered subcutaneously should be initiated as maintenance therapy 4 weeks after the last administration of two intravenous infusions of infliximab 5 mg/kg given 2 weeks apart. The recommended dose for Remsima subcutaneous formulation is 120 mg once every 2 weeks. Psoriasis Treatment with Remsima administered subcutaneously should be initiated as maintenance therapy 4 weeks after the last administration of two intravenous infusions of infliximab 5 mg/kg given 2 weeks apart. The recommended dose for Remsima subcutaneous formulation is 120 mg once every 2 weeks. If a patient shows no response after 14 weeks (i.e. 2 intravenous infusions and 5 subcutaneous injections), no additional treatment with infliximab should be given. Re-administration for Crohn’s disease and rheumatoid arthritis From experience with intravenous infliximab, if the signs and symptoms of disease recur, infliximab can be re-administered within 16 weeks following the last administration. In clinical studies with intravenous infliximab, delayed hypersensitivity reactions have been uncommon and have occurred after infliximab-free intervals of less than 1 year (see sections 4.4 and 4.8). The safety and efficacy of re-administration after an infliximab-free interval of more than 16 weeks has not been established. This applies to both Crohn’s disease patients and rheumatoid arthritis patients. Re-administration for ulcerative colitis From experience with intravenous infliximab, the safety and efficacy of re-administration, other than every 8 weeks, has not been established (see sections 4.4 and 4.8). Re-administration for ankylosing spondylitis From experience with intravenous infliximab, the safety and efficacy of re-administration, other than every 6 to 8 weeks, has not been established (see sections 4.4 and 4.8). Re-administration for psoriatic arthritis From experience with intravenous infliximab, the safety and efficacy of re-administration, other than every 8 weeks, has not been established (see sections 4.4 and 4.8). Re-administration for psoriasis Limited experience from re-treatment with one single intravenous infliximab dose in psoriasis after an interval of 20 weeks suggests reduced efficacy and a higher incidence of mild to moderate infusion reactions when compared to the initial induction regimen (see section 5.1). Limited experience from re-treatment of intravenous infliximab following disease flare by a re- induction regimen suggests a higher incidence of infusion reactions, including serious ones, when compared to 8-weekly maintenance treatment of intravenous infliximab (see section 4.8). Re-administration across indications In case maintenance therapy is interrupted, and there is a need to restart treatment, use of a re-induction regimen of intravenous infliximab is not recommended (see section 4.8). In this situation, infliximab should be re-initiated as a single dose of intravenous infliximab followed by the maintenance dose recommendations of subcutaneous infliximab described above given 4 weeks after the last administration of intravenous infliximab. Switching to and from Remsima subcutaneous formulation across indications When switching from the maintenance therapy of infliximab intravenous formulation to the subcutaneous formulation of Remsima, the subcutaneous formulation may be administered 8 weeks after the last administration of infliximab 100 mg I.V. There is insufficient information regarding the switching of patients who received Remsima 100 mg I.V. higher than 3 mg/kg for rheumatoid arthritis or 5 mg/kg for Crohn’s disease every 8 weeks to the subcutaneous formulation of Remsima. Information regarding switching patients from the subcutaneous formulation to the intravenous formulation of Remsima is not available. Missed dose If patients miss an injection of Remsima subcutaneous formulation, they should be instructed to take the missed dose immediately in case this happens within 7 days from the missed dose, and then remain on their original dosing schedule. If the dose is delayed by 8 days or more, the patients should be instructed to skip the missed dose, wait until their next scheduled dose, and then remain on their original dosing schedule. Special populations Elderly Specific studies of infliximab in elderly patients have not been conducted. No major age-related differences in clearance or volume of distribution were observed in clinical studies with infliximab intravenous formulations and the same is expected for subcutaneous formulation. No dose adjustment is required (see section 5.2). For more information about the safety of infliximab in elderly patients (see sections 4.4 and 4.8). Renal and/or hepatic impairment Infliximab has not been studied in these patient populations. No dose recommendations can be made (see section 5.2). Paediatric population Remsima 120 mg/ml S.C. is not indicated for children and adolescents under 18 years old. The safety and efficacy of Remsima subcutaneous therapy in children aged below 18 years of age have not yet been established. No data are available. Method of administration Remsima 120 mg/ml S.C. solution for injection in pre-filled syringe or in pre-filled pen are administered by subcutaneous injection only. Full instructions for use are provided in the package leaflet. For the two initial intravenous infusions, patients may be pre-treated with, e.g., an antihistamine, hydrocortisone and/or paracetamol and infusion rate may be slowed in order to decrease the risk of infusion-related reactions especially if infusion-related reactions have occurred previously (see section 4.4). The physician should ensure appropriate follow-up of patients for any systemic injection reaction and localised injection site reaction after the initial subcutaneous injection is administered.

פרטי מסגרת הכללה בסל
א. התרופה תינתן לטיפול בחולה הסובל מאחד מאלה: 1. טיפול במחלת קרוהן בדרגת חומרה בינונית עד קשה בחולים שמיצו טיפול קודם – טיפול לא ביולוגי או טיפול ביולוגי;2. ארתריטיס ראומטואידית - אם החולה לא הגיב לטיפול ב-METHOTREXATE והטיפול דרוש לצורך הפחתת הסימנים והתסמינים; הטיפול יינתן בשילוב עם METHOTREXATE ובכפוף לתנאי פסקה ב; 3. דלקת פרקים פסוריאטית קשה אם החולה לא הגיב לטיפול בתרופות methotrexate, salazopyrin ממשפחת ה-DMARDs. הטיפול יינתן בשילוב עם methotrexate; 4. אנקילוזינג ספונדילטיס קשה אם החולה לא הגיב לטיפול קונבנציונלי. במקרה של הוריאנט דמוי אנקילוזינג ספונדיליטיס הקשור בפסוריאזיס, תהיה ההוריה כמו באנקילוזינג ספונדיליטיס ראשונית; 5. פסוריאזיס - בהתקיים כל אלה: א. החולה סובל מאחד מאלה: 1. מחלה מפושטת מעל ל-50% של שטח גוף או PASI מעל 50. 2. נגעים באזורי גוף רגישים - אזורים אלו יכללו פנים, צוואר, קיפולי עור, כפות ידיים, כפות רגליים, אזור הגניטליה והישבן; ב. החולה קיבל שני טיפולים סיסטמיים לפחות בלא שיפור של 50% לפחות ב-PASI לאחר סיום הטיפול בהשוואה לתחילת הטיפול; בהתייחס לחולה העונה על האמור בפסקת משנה (א)(2) - החולה קיבל שני טיפולים סיסטמיים לפחות בלא שיפור משמעותי לאחר סיום הטיפול בהשוואה לתחילת הטיפול; ג. התרופה תינתן על פי מרשם של רופא מומחה בדרמטולוגיה. 6. טיפול במחלת מעי דלקתית מסוג Ulcerative colitis בחולים שמיצו טיפול קודם – טיפול לא ביולוגי או טיפול ביולוגי;ב. הטיפול בתרופה לחולה העונה על תנאי פסקה (א) (2), יינתן בהתקיים כל אלה: 1. קיימת עדות לדלקת פרקים (RA-Rheumatoid Arthritis) פעילה המתבטאת בשלושה מתוך אלה: א. מחלה דלקתית (כולל כאב ונפיחות) בארבעה פרקים ויותר; ב. שקיעת דם או CRP החורגים מהנורמה באופן משמעותי (בהתאם לגיל החולה); ג. שינויים אופייניים ל-RA בצילומי רנטגן של הפרקים הנגועים; ד. פגיעה תפקודית המוגדרת כהגבלה משמעותית בתפקודו היומיומי של החולה ובפעילותו בעבודה. 2. לאחר מיצוי הטיפול בתרופות השייכות למשפחת ה-NSAIDs ובתרופות השייכות למשפחת ה-DMARDs. לעניין זה יוגדר מיצוי הטיפול כהעדר תגובה קלינית לאחר טיפול קו ראשון בתרופות אנטי דלקתיות ממשפחת ה-NSAIDs וטיפול קו שני ב-3 תרופות לפחות ממשפחת ה-DMARDs שאחת מהן מתוטרקסאט, במשך 3 חודשים רצופים לפחות. 3. הטיפול יינתן באישור רופא מומחה בראומטולוגיה.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| פסוריאזיס, בהתקיים כל התנאים האלה: (1) החולה סובל מאחד מאלה: (א) מחלה מפושטת מעל ל-50% של שטח גוף או PASI מעל 50; (ב) נגעים באזורי גוף רגישים; (2) החולה קיבל שני טיפולים סיסטמיים לפחות בלא שיפור של 50% לפחות ב-PASI לאחר סיום הטיפול בהשוואה לתחילת הטיפול; בהתייחס לחולה העונה על האמור בפסקת משנה (1)(ב) – החולה קיבל שני טיפולים סיסטמיים לפחות בלא שיפור משמעותי לאחר סיום הטיפול בהשוואה לתחילת הטיפול; (3) התרופה תינתן על פי מרשם של רופא מומחה בדרמטולוגיה | 03/01/2010 | עור ומין | ADALIMUMAB, IXEKIZUMAB, CERTOLIZUMAB PEGOL, USTEKINUMAB, SECUKINUMAB, TILDRAKIZUMAB, GUSELKUMAB, ETANERCEPT, INFLIXIMAB | Psoriasis |
| טיפול במחלת מעי דלקתית מסוג Ulcerative colitis לאחר מיצוי כל קווי טיפול תרופתיים קיימים | 01/03/2008 | גסטרואנטרולוגיה | Ulcerative colitis | |
| פסוריאזיס בהתקיים כל התנאים האלה א. החולה סובל מפסוריאזיס מפושטת מעל ל-50% של שטח גוף או PASI מעל 50. ב. הטיפול עם התכשיר יינתן לחולים אשר קיבלו לפחות שני טיפולים סיסטמיים ללא שיפור של 50% לפחות ב-PASI לאחר סיום הטיפול בהשוואה לתחילת הטיפול. ג. לא יעשה שימוש בשתי תרופות מקבוצה זו (התרופות בקלאס אפקט) בתוך 12 חודשים, אלא אם קיימת אי סבילות או תופעות לוואי לתרופה המחייבות זאת. ד. התרופה תינתן על פי מרשם של רופא מומחה בדרמטולוגיה. | 15/05/2006 | עור ומין | EFALIZUMAB, ALEFACEPT, ETANERCEPT, INFLIXIMAB | Psoriasis |
| דלקת מפרקים ראומטואידית אם החולה לא הגיב לטיפול ב-Methtorexate והטיפול דרוש לצורך הפחתת הסימנים והתסמינים; הטיפול יינתן בשילוב Methotrexate בהתקיים כל התנאים הבאים 1. קיימת עדות לדלקת מפרקים מסוג Rheumatoid arthritis פעילה המתבטאת בשלושה מתוך אלה: א. מחלה דלקתית בארבעה מפרקים ויותר ב. שקיעת דם או C reactive protein מעל הנורמה ג. שינויים אופייניים לדלקת מפרקים ראומטואידית במפרקים הנגועים ד. פגיעה תפקודית לאחר מיצוי הטיפול בתרופות השייכות למשפחת ה-NSAIDs (Non steroidal anti inflammatory drugs) ובתרופות השייכות למשפחת DMARDs (Disease modifying antirheumatic drugs). 2. התרופה תינתן על פי המלצה של רופא מומחה בראומטולוגיה. | 15/04/2005 | ראומטולוגיה | Rheumatoid arthritis | |
| אנקילוזינג ספונדיליטיס קשה – אם החולה לא הגיב לטיפול קונבנציונלי. הטיפול יינתן בשילוב עם Methotrexate, למעט במקרה של הורית נגד לתרופה זאת. התרופה תינתן על פי המלצה של רופא מומחה בראומטולוגיה. | 15/04/2005 | ראומטולוגיה | Ankylosing spondylitis | |
| דלקת מפרקים פסוריאטית קשה – אם החולה לא הגיב לטיפול בתרופות Salazopyrine, Methotrexate ממשפחת ה-DMARDs. הטיפול יינתן בשילוב עם Methotrexate. (במקרה של הוריאנט דמוי Ankylosing spondylitis הקשור בפסוריאזיס תהיה ההוריה כמו ב-Ankylosing spondylitis ראשוני). התרופה תינתן על פי המלצה של רופא מומחה בראומטולוגיה. | 15/04/2005 | ראומטולוגיה | Psoriatic arthritis | |
| ארתריטיס ראומטואידית – אם החולה לא הגיב לטיפול ב-METHOTREXATE והטיפול דרוש לצורך הפחתת הסימנים והתסמינים; הטיפול ינתן בשילוב עם METHOTREXATE. התוויות למתן הטיפול: הטיפול בחוסמי TNF מיועד רק לחולי ארתריטיס ראומטואידית פעילה, בהתקיים כל התנאים שיפורטו להלן: 1. עדות קלינית מעבדתית, רנטגנית ותפקודית לדלקת פרקים (RA) פעילה (לפחות 3 מתוך 4 הבאים): א. פגיעה קלינית מוגדרת כמחלה דלקתית (כולל כאב ונפיחות) במספר פרקים בו זמנית (לפחות 4 פרקים) ב. עדות מעבדתית למחלה דלקתית פעילה מוגדרת – שקיעת דם ו/או CRP החוגרים מהנורמה באופן משמעותי (בהתאם לגיל החולה). ג. עדות רנטגנית מוגדרת כשינויים אופייניים ל-RA בצילומי הרנטגן של הפרקים הנגועים. הערה: קיום אנקילוזות במרבית הפרקים (כביטוי לשלב הקליני הסופי של המחלה), אינו מהווה הוריה למתן הטיפול. ד. פגיעה תפקודית עקב מחלה פעילה מוגדרת כהגבלה משמעותית בתפקודו היומיומי של החוולה ובפעילותו בעבודה. 2. ניסיון טיפולי קודם בתרופות הבאות: א. טיפול קו ראשון בתרופות אנטי דלקתיות מסוג NSAID ב. טיפול קו שני ב-3 תרופות לפחות מקבוצת ה-DMARD שאחת מהן מתוטרקסט, במשך 3 חודשים רצופים לפחות. קבוצת התרופות DMARD (Disease modifying antirheumatic drugs) כוללת: מתוטרקסט, מלחי זהב, אנטימלריאלים, דיפניצילאמין, סולפהסלזין, אזאתיופרין, מינוציקלין. כשלון טיפולי יוגדר כהעדר תגובה קלינית לאחר טיפול של 3 חודשים רצופים לפחות בטיפול של 3 תרופות מקבוצת ה-DMARD, שאחת מהן מתוטרקסט. כשלון טיפול ב-Infliximab יוגדר כהעדר תגובה קלינית לאחר טיפול ב-4 מנות של התכשיר במתן תוך ורידי. הנחיות למתן הטיפול חוסמי TNF יינתנו כטיפול קו שלישי רק לאחר כשלון טיפולי בתרופות קו שני ולפי ההוריות הבאות: 1. הטיפול ב-Infliximab ב-Adult RA יינתן בשילוב עם Methotrexate. 2. התרופה Etanercept תינתן: א. לטיפול במחלת ארתריטיס כרונית בצעירים (Juvenile chronic arthritis) לאחר כשלון טיפולי במתוטרקסט. ב. לטיפול ב-Adult RA לאחר כשלון טיפולי ב-DMARD כמתואר לעיל, ולאחר כשלון טיפולי ב-Infliximab. שמירת רצף טיפול בחוסמי TNF ישמר הרצף הטיפולי במתן חוסמי TNF בחולים אשר ענו על ההתוויות הקליניות המוגדרות לפני תחילת הטיפול, באותה תרופה בה הותחל הטיפול לפני 01.01.02 וקיימת הוכחה ליעילות הטיפול. אישור מתן הטיפול הטיפול בחוסמי TNF בחולי ארתריטיס ראומטואידית יינתן באישור וועדה בראשות רופא מומחה בראומטולוגיה. | 01/03/2002 | ראומטולוגיה | Rheumatoid arthritis | |
| בחולה הסובל מאחד מאלה: (א) מחלת קרוהן פעילה בינונית עד חמורה, לצורך הקלת הסימנים והתסמינים. (ב) מחלת קרוהן מסוג fistulizing - לצורך הפחתת מספר הפיסטולות האנטרו-עוריות המנקזות (draining enterocutaneous fistulas). | 16/01/2000 | גסטרואנטרולוגיה | Crohn's disease |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
16/01/2000
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
עלון מידע לצרכן
18.05.22 - עלון לצרכן אנגלית 18.05.22 - עלון לצרכן עברית 18.05.22 - עלון לצרכן ערבית 20.12.21 - עלון לצרכן אנגלית 14.06.22 - עלון לצרכן עברית 20.12.21 - עלון לצרכן ערבית 12.10.22 - עלון לצרכן אנגלית 12.10.22 - עלון לצרכן עברית 12.10.22 - עלון לצרכן ערבית 29.05.23 - עלון לצרכן אנגלית 29.05.23 - עלון לצרכן עברית 29.05.23 - עלון לצרכן ערבית 08.06.23 - עלון לצרכן אנגלית 08.06.23 - עלון לצרכן עברית 08.06.23 - עלון לצרכן ערבית 15.08.23 - עלון לצרכן אנגלית 15.08.23 - עלון לצרכן עברית 15.08.23 - עלון לצרכן ערבית 24.10.23 - עלון לצרכן עברית 25.10.23 - עלון לצרכן עברית 20.12.23 - עלון לצרכן אנגלית 20.12.23 - עלון לצרכן עברית 20.12.23 - עלון לצרכן ערבית 20.12.21 - החמרה לעלון 10.05.23 - החמרה לעלון 19.10.23 - החמרה לעלוןלתרופה במאגר משרד הבריאות
רמסימה 120 מ"ג/מ"ל תת-עורי