Quest for the right Drug
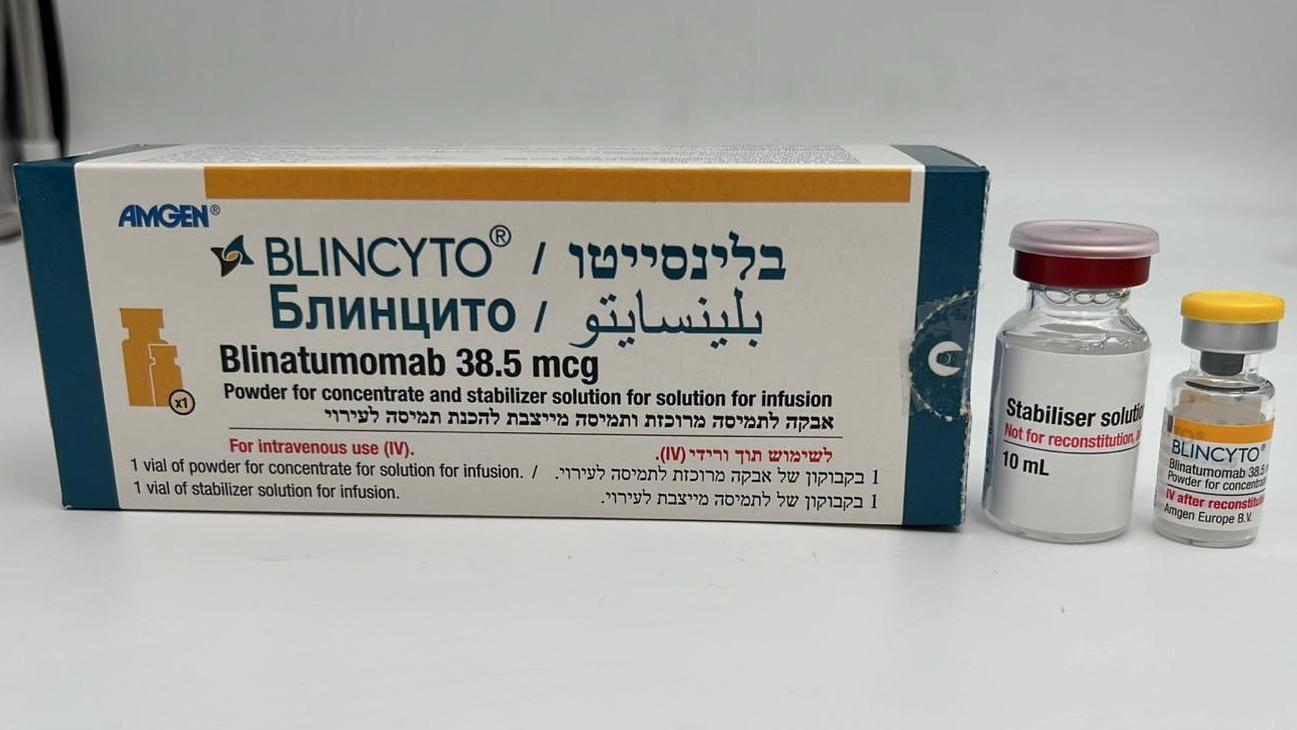
בלינסייטו BLINCYTO (BLINATUMOMAB)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תוך-ורידי : I.V
צורת מינון:
אבקה להכנת תמיסה מרוכזת לעירוי : POWDER FOR CONCENTRATE FOR SOLUTION FOR INFUSION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Pharmaceutical particulars : מידע רוקחי
6. PHARMACEUTICAL PARTICULARS 6.1 List of excipients Powder Citric acid monohydrate (E330) Trehalose dihydrate Lysine hydrochloride Polysorbate 80 Sodium hydroxide NF (for pH-adjustment) Solution (stabilizer) Citric acid monohydrate (E330) Lysine hydrochloride Polysorbate 80 Sodium hydroxide NF (for pH-adjustment) Water for injections 6.2 Incompatibilities This medicinal product must not be mixed with other medicinal products except those mentioned in section 6.6. 6.3 Shelf life Unopened vials The expiry date of the product is indicated on the packaging materials. Reconstituted solution Chemical and physical in-use stability has been demonstrated for 24 hours at 2°C – 8°C or 4 hours at room temperature (23°C - 27°C). Keep in the outer carton to protect from light. From a microbiological point of view, unless the method of reconstituting precludes the risks of microbial contamination, the reconstituted solution should be diluted immediately. If not diluted immediately, in-use storage times and conditions are the responsibility of the user. Diluted solution (prepared infusion bag) Chemical and physical in-use stability has been demonstrated for 10 days at 2°C – 8°C or 96 hours at room temperature (23°C – 27°C). From a microbiological point of view, the prepared infusion bags should be used immediately. If not used immediately, in-use storage times and conditions prior to use are the responsibility of the user and would normally not be longer than 24 hours at 2°C – 8°C, unless dilution has taken place in controlled and validated aseptic conditions. 6.4 Special precautions for storage Store and transport refrigerated (2°C – 8°C). Do not freeze. Store the vials in the original package in order to protect from light. After removal from the refrigerator, BLINCYTO may be stored at room temperature (23°C – 27°C) and used within 8 hours. For storage conditions after reconstitution and dilution of the medicinal product, see section 6.3. 6.5 Nature and contents of container Each BLINCYTO pack contains 1 vial of powder for concentrate for solution for infusion and 1 vial of solution (stabilizer): • 38.5 micrograms blinatumomab powder in a vial (type I glass) with a stopper (elastomeric rubber), seal (aluminum) and a flip off cap, and • 10 mL solution in a vial (type I glass) with a stopper (elastomeric rubber), seal (aluminum) and a flip off cap. 6.6 Special precautions for disposal and other handling Aseptic preparation Aseptic handling must be ensured when preparing the infusion. Preparation of BLINCYTO should be: - performed under aseptic conditions by trained personnel in accordance with good practice rules especially with respect to the aseptic preparation of parenteral products. - prepared in a laminar flow hood or biological safety cabinet using standard precautions for the safe handling of intravenous agents. It is very important that the instructions for preparation and administration provided in this section are strictly followed to minimize medication errors (including underdose and overdose). Other instructions • BLINCYTO is compatible with polyolefin, PVC non-di-ethylhexylphthalate (non-DEHP), or ethyl vinyl acetate (EVA) infusion bags/pump cassettes. • At the end of infusion, any unused medicinal product or waste material should be disposed of in accordance with local requirements. Preparation of the solution for infusion These supplies are also required, but not included in the package • Sterile single-use disposable syringes • 21 - 23 gauge needle(s) (recommended) • Water for injections • Infusion bag with 250 mL sodium chloride 9 mg/mL (0.9%) solution for injection; o To minimize the number of aseptic transfers, use a 250 mL pre-filled infusion bag. BLINCYTO dose calculations are based on a usual overfill volume of 265 to 275 mL sodium chloride 9 mg/mL (0.9%) solution for injection. o Use only polyolefin, PVC non-di-ethylhexylphthalate (non-DEHP), or ethyl vinyl acetate (EVA) infusion bags/pump cassettes. • Polyolefin, PVC non-DEHP, or EVA intravenous tubing with a sterile, non-pyrogenic, low protein-binding 0.2 micrometer in-line filter. o Ensure that the tubing is compatible with the infusion pump. Reconstitute BLINCYTO with water for injections. Do not reconstitute BLINCYTO vials with the solution (stabilizer). To prime the intravenous tubing, use only the solution in the bag containing the FINAL prepared BLINCYTO solution for infusion. Do not prime with sodium chloride 9 mg/mL (0.9%) solution for injection. Reconstitution of BLINCYTO 1. Determine the number of BLINCYTO vials needed for a dose and infusion duration. 2. Using a syringe, reconstitute each vial of BLINCYTO powder for concentrate using 3 mL of water for injections. Direct the water along the walls of the BLINCYTO vial and not directly on the lyophilized powder. • Do not reconstitute BLINCYTO powder for concentrate with the solution (stabilizer). • The addition of water for injections to the powder for concentrate results in a total volume of 3.08 mL for a final BLINCYTO concentration of 12.5 mcg/mL. 3. Gently swirl contents to avoid excess foaming. • Do not shake. 4. Visually inspect the reconstituted solution for particulate matter and discoloration during reconstitution and prior to infusion. The resulting solution should be clear to slightly opalescent, colorless-to-slightly yellow. • Do not use if the solution is cloudy or has precipitated. Preparation of BLINCYTO infusion bag Verify the prescribed dose and infusion duration for each BLINCYTO infusion bag. To minimize errors, use the specific volumes described in Tables 13 and 14 to prepare the BLINCYTO infusion bag. • Table 13 for patients weighing greater than or equal to 45 kg • Table 14 for patients weighing less than 45 kg 1. Use an infusion bag pre-filled with 250 mL sodium chloride 9 mg/mL (0.9%) solution for injection that usually contains a total volume of 265 to 275 mL. 2. To coat the infusion bag, using a syringe, aseptically transfer 5.5 mL of the solution (stabilizer) to the infusion bag. Gently mix the contents of the bag to avoid foaming. Discard the remaining solution (stabilizer). 3. Using a syringe, aseptically transfer the required volume of reconstituted BLINCYTO solution into the infusion bag containing sodium chloride 9 mg/mL (0.9%) solution for injection and the solution (stabilizer). Gently mix the contents of the bag to avoid foaming. • Refer to table 13 for patients weighing greater than or equal to 45 kg for the specific volume of reconstituted BLINCYTO. • Refer to table 14 for patients weighing less than 45 kg (dose based on BSA) for the specific volume of reconstituted BLINCYTO. • Discard the vial containing any unused BLINCYTO reconstituted solution. 4. Under aseptic conditions, attach the intravenous tubing to the infusion bag with the sterile 0.2 micron in-line filter. Ensure that the intravenous tubing is compatible with the infusion pump. 5. Remove air from the infusion bag. This is particularly important for use with an ambulatory infusion pump. 6. Prime the intravenous infusion line only with the solution in the bag containing the FINAL prepared BLINCYTO solution for infusion. 7. Store refrigerated at 2°C – 8°C if not used immediately. Table 13. For patients weighing greater than or equal to 45 kg: volumes of sodium chloride 9 mg/mL (0.9%) solution for injection, solution (stabilizer), and reconstituted BLINCYTO to add to infusion bag Sodium chloride 9 mg/mL (0.9%) solution for injection 250 mL (starting volume) (usual overfill volume of 265 to 275 mL) Solution (stabilizer) (fixed volume for 24, 48, 72, and 5.5 mL 96-hour infusion durations) Reconstituted Infusion Dose Infusion rate BLINCYTO duration Volume Vials 9 mcg/day 10 mL/hour 0.83 mL 1 24 hours 28 mcg/day 10 mL/hour 2.6 mL 1 9 mcg/day 5 mL/hour 1.7 mL 1 48 hours 28 mcg/day 5 mL/hour 5.2 mL 2 9 mcg/day 3.3 mL/hour 2.5 mL 1 72 hours 28 mcg/day 3.3 mL/hour 8 mL 3 9 mcg/day 2.5 mL/hour 3.3 mL 2 96 hours 28 mcg/day 2.5 mL/hour 10.7 mL 4 Table 14. For patients weighing less than 45 kg: volumes of sodium chloride 9 mg/mL (0.9%) solution for injection, solution (stabilizer), and reconstituted BLINCYTO to add to infusion bag Sodium chloride 9 mg/mL (0.9%) solution for injection 250 mL (starting volume) (usual overfill volume of 265 to 275 mL) Solution (stabilizer) (fixed volume for 24, 48, 72, and 5.5 mL 96-hour infusion durations) Infusion Dose Infusion rate BSA (m2) Reconstituted BLINCYTO duration Volume Vials 1.5 – 1.59 0.7 mL 1 1.4 – 1.49 0.66 mL 1 1.3 – 1.39 0.61 mL 1 1.2 – 1.29 0.56 mL 1 1.1 – 1.19 0.52 mL 1 1 – 1.09 0.47 mL 1 24 hours 5 mcg/m2/day 10 mL/hour 0.9 – 0.99 0.43 mL 1 0.8 – 0.89 0.38 mL 1 0.7 – 0.79 0.33 mL 1 0.6 – 0.69 0.29 mL 1 0.5 – 0.59 0.24 mL 1 0.4 – 0.49 0.2 mL 1 1.5 – 1.59 2.1 mL 1 1.4 – 1.49 2 mL 1 1.3 – 1.39 1.8 mL 1 1.2 – 1.29 1.7 mL 1 1.1 – 1.19 1.6 mL 1 1 – 1.09 1.4 mL 1 24 hours 15 mcg/m2/day 10 mL/hour 0.9 – 0.99 1.3 mL 1 0.8 – 0.89 1.1 mL 1 0.7 – 0.79 1 mL 1 0.6 – 0.69 0.86 mL 1 0.5 – 0.59 0.72 mL 1 0.4 – 0.49 0.59 mL 1 Sodium chloride 9 mg/mL (0.9%) solution for injection 250 mL (starting volume) (usual overfill volume of 265 to 275 mL) Solution (stabilizer) (fixed volume for 24, 48, 72, and 5.5 mL 96-hour infusion durations) Infusion Dose Infusion rate BSA (m2) Reconstituted BLINCYTO duration Volume Vials 1.5 – 1.59 1.4 mL 1 1.4 – 1.49 1.3 mL 1 1.3 – 1.39 1.2 mL 1 1.2 – 1.29 1.1 mL 1 1.1 – 1.19 1 mL 1 1 – 1.09 0.94 mL 1 48 hours 5 mcg/m2/day 5 mL/hour 0.9 – 0.99 0.85 mL 1 0.8 – 0.89 0.76 mL 1 0.7 – 0.79 0.67 mL 1 0.6 – 0.69 0.57 mL 1 0.5 – 0.59 0.48 mL 1 0.4 – 0.49 0.39 mL 1 1.5 – 1.59 4.2 mL 2 1.4 – 1.49 3.9 mL 2 1.3 – 1.39 3.7 mL 2 1.2 – 1.29 3.4 mL 2 1.1 – 1.19 3.1 mL 2 1 – 1.09 2.8 mL 1 48 hours 15 mcg/m2/day 5 mL/hour 0.9 – 0.99 2.6 mL 1 0.8 – 0.89 2.3 mL 1 0.7 – 0.79 2 mL 1 0.6 – 0.69 1.7 mL 1 0.5 – 0.59 1.4 mL 1 0.4 – 0.49 1.2 mL 1 Sodium chloride 9 mg/mL (0.9%) solution for injection 250 mL (starting volume) (usual overfill volume of 265 to 275 mL) Solution (stabilizer) (fixed volume for 24, 48, 72, and 5.5 mL 96-hour infusion durations) Infusion Dose Infusion rate BSA (m2) Reconstituted BLINCYTO duration Volume Vials 1.5 – 1.59 2.1 mL 1 1.4 – 1.49 2 mL 1 1.3 – 1.39 1.8 mL 1 1.2 – 1.29 1.7 mL 1 1.1 – 1.19 1.6 mL 1 1 – 1.09 1.4 mL 1 72 hours 5 mcg/m2/day 3.3 mL/hour 0.9 – 0.99 1.3 mL 1 0.8 – 0.89 1.1 mL 1 0.7 – 0.79 1 mL 1 0.6 – 0.69 0.86 mL 1 0.5 – 0.59 0.72 mL 1 0.4 – 0.49 0.59 mL 1 1.5 – 1.59 6.3 mL 3 1.4 – 1.49 5.9 mL 3 1.3 – 1.39 5.5 mL 2 1.2 – 1.29 5.1 mL 2 1.1 – 1.19 4.7 mL 2 1 – 1.09 4.2 mL 2 72 hours 15 mcg/m2/day 3.3 mL/hour 0.9 – 0.99 3.8 mL 2 0.8 – 0.89 3.4 mL 2 0.7 – 0.79 3 mL 2 0.6 – 0.69 2.6 mL 1 0.5 – 0.59 2.2 mL 1 0.4 – 0.49 1.8 mL 1 Sodium chloride 9 mg/mL (0.9%) solution for injection 250 mL (starting volume) (usual overfill volume of 265 to 275 mL) Solution (stabilizer) (fixed volume for 24, 48, 72, and 5.5 mL 96-hour infusion durations) Infusion Dose Infusion rate BSA (m2) Reconstituted BLINCYTO duration Volume Vials 1.5 – 1.59 2.8 mL 1 1.4 – 1.49 2.6 mL 1 1.3 – 1.39 2.4 mL 1 1.2 – 1.29 2.3 mL 1 1.1 – 1.19 2.1 mL 1 1 – 1.09 1.9 mL 1 96 hours 5 mcg/m2/day 2.5 mL/hour 0.9 – 0.99 1.7 mL 1 0.8 – 0.89 1.5 mL 1 0.7 – 0.79 1.3 mL 1 0.6 – 0.69 1.2 mL 1 0.5 – 0.59 0.97 mL 1 0.4 – 0.49 0.78 mL 1 1.5 – 1.59 8.4 mL 3 1.4 – 1.49 7.9 mL 3 1.3 – 1.39 7.3 mL 3 1.2 – 1.29 6.8 mL 3 1.1 – 1.19 6.2 mL 3 1 – 1.09 5.7 mL 3 96 hours 15 mcg/m2/day 2.5 mL/hour 0.9 – 0.99 5.1 mL 2 0.8 – 0.89 4.6 mL 2 0.7 – 0.79 4 mL 2 0.6 – 0.69 3.4 mL 2 0.5 – 0.59 2.9 mL 2 0.4 – 0.49 2.3 mL 1 BSA = body surface area 7. MARKETING AUTHORIZATION HOLDER Amgen Europe B.V. Minervum 7061 NL-4817 ZK Breda The Netherlands

פרטי מסגרת הכללה בסל
א. התרופה תינתן לטיפול במקרים אלה:1. חולים בגירים הלוקים בלוקמיה מסוג Philadelphia chromosome-negative B cell precursor acute lymphoblastic leukemia (ALL)) עמידה או חוזרת (Relapsed / Refractory).במהלך מחלתו יהיה החולה זכאי לטיפול בתרופה אחת בלבד מהתרופות המפורטות להלן – Blinatumomab, Inotuzumab ozogamicin, למעט בחולה אשר לא השיג תגובה מינימלית לאחר ניסיון טיפולי של מחזור טיפול אחד באחת מהתרופות האמורות.2. ילדים בני שנה ומעלה הלוקים בלוקמיה מסוג Philadelphia chromosome-negative CD19+ B cell precursor acute lymphoblastic leukemia (ALL) עמידה או חוזרת (Relapsed / Refractory).לעניין זה מחלה חוזרת תוגדר בחולה שקיבל שני קווי טיפול קודמים או שעבר השתלה אלוגנאית של תאי גזע המטופואטיים.הטיפול לא יינתן כטיפול אחזקה.3. כמונותרפיה במבוגרים עם Philadelphia chromosome-negative CD19+ B cell precursor acute lymphoblastic leukemia (ALL) בהפוגה ראשונה או שניה עם מחלה שארית מינימלית (MRD – minimal residual disease) בערך של 0.1% ומעלה. מחזור יחיד כחלק מטיפול קונסולידציה, בילדים חולי לוקמיה מסוג Philadelphia chromosome negative CD19 positive B-precursor ALL בסיכון גבוה, בחזרת מחלה ראשונה.לעניין זה הישנות בסיכון גבוה תוגדר כהישנות המתרחשת בתוך פחות מ-6 חודשים מסיום הטיפול הראשוני.4. מחזור יחיד כחלק מטיפול קונסולידציה, בילדים חולי לוקמיה מסוג Philadelphia chromosome negative CD19 positive B-precursor ALL בסיכון גבוה, בחזרת מחלה ראשונה.לעניין זה הישנות בסיכון גבוה תוגדר כהישנות המתרחשת בתוך פחות מ-6 חודשים מסיום הטיפול הראשוני.ב. מתן התרופה ייעשה לפי מרשם של מומחה באונקולוגיה או רופא מומחה בהמטולוגיה.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| מונותרפיה במבוגרים עם Philadelphia chromosome-negative CD19+ B cell precursor acute lymphoblastic leukemia (ALL) בהפוגה ראשונה או שניה עם מחלה שארית מינימלית (MRD – minimal residual disease) בערך של 0.1% ומעלה | 30/01/2020 | אונקולוגיה | Acute lymphoblastic leukemia, ALL | |
| חולים בגירים הלוקים בלוקמיה מסוג Philadelphia chromosome-negative B cell precursor acute lymphoblastic leukemia (ALL)) עמידה או חוזרת (Relapsed / Refractory). במהלך מחלתו יהיה החולה זכאי לטיפול בתרופה אחת בלבד מהתרופות המפורטות להלן - Blinatumomab, Inotuzumab ozogamicin, למעט בחולה אשר לא השיג תגובה מינימלית לאחר ניסיון טיפולי של מחזור טיפול אחד באחת מהתרופות האמורות. | 30/01/2020 | אונקולוגיה | Acute lymphoblastic leukemia, ALL | |
| ילדים בני שנה ומעלה הלוקים בלוקמיה מסוג Philadelphia chromosome-negative CD19+ B cell precursor acute lymphoblastic leukemia (ALL) עמידה או חוזרת (Relapsed / Refractory). | 16/01/2019 | אונקולוגיה | Acute lymphoblastic leukemia, ALL | |
| התרופה תינתן לטיפול בחולים בגירים הלוקים בלוקמיה מסוג Philadelphia chromosome-negative B cell precursor acute lymphoblastic leukemia (ALL)) עמידה או חוזרת (Relapsed / Refractory). | 12/01/2017 | אונקולוגיה | Acute lymphoblastic leukemia, ALL | |
| התרופה תינתן לטיפול בחולים הלוקים בלוקמיה מסוג Philadelphia chromosome-negative B cell precursor acute lymphoblastic leukemia (ALL) בחולים בגירים, בהם מתקיימים כל התנאים הבאים: א. החולה חווה חזרת מחלה במהלך השנה הראשונה שלאחר טיפול כימותרפי והשתלת מח עצם (first relapse) (עד שנה מהשתלת מח העצם). ב. החולה מועמד להשתלת מח עצם אלוגנאית (השתלה שניה). ג. בדמו של החולה נספר מספר בלסטים הנמוך מ-50%. ד. מתן התרופה ייעשה לפי מרשם של מומחה באונקולוגיה או רופא מומחה בהמטולוגיה. | 21/01/2016 | אונקולוגיה | Acute lymphoblastic leukemia, ALL | |
| מחזור יחיד כחלק מטיפול קונסולידציה, בילדים חולי לוקמיה מסוג Philadelphia chromosome negative CD19 positive B-precursor ALL בסיכון גבוה, בחזרת מחלה ראשונה. לעניין זה הישנות בסיכון גבוה תוגדר כהישנות המתרחשת בתוך פחות מ-6 חודשים מסיום הטיפול הראשוני. | 03/02/2022 | אונקולוגיה | Acute lymphoblastic leukemia, ALL |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
21/01/2016
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
עלון מידע לצרכן
17.05.18 - עלון לצרכן 07.03.19 - עלון לצרכן 16.09.19 - עלון לצרכן 01.02.22 - עלון לצרכן אנגלית 01.02.22 - עלון לצרכן עברית 01.02.22 - עלון לצרכן ערבית 01.02.22 - עלון לצרכן אנגלית 01.02.22 - עלון לצרכן אנגלית 01.02.22 - עלון לצרכן אנגלית 14.03.22 - עלון לצרכן אנגלית 01.02.22 - עלון לצרכן אנגלית 01.02.22 - עלון לצרכן עברית 01.02.22 - עלון לצרכן ערבית 13.03.22 - עלון לצרכן אנגלית 13.03.22 - עלון לצרכן עברית 13.03.22 - עלון לצרכן ערבית 04.09.23 - עלון לצרכן אנגלית 04.09.23 - עלון לצרכן עברית 04.09.23 - עלון לצרכן ערבית 09.06.20 - החמרה לעלון 27.04.21 - החמרה לעלון 13.03.22 - החמרה לעלון 04.09.23 - החמרה לעלון 16.11.23 - החמרה לעלוןלתרופה במאגר משרד הבריאות
בלינסייטו